گروهی پژوهشی به رهبری جمعی از دانشمندان دانشگاه بوفالو، دریافتند که با تمرکز روی تغییرات ژنی ایجادشده توسط عواملی بهغیر از توالی DNA (عوامل اپیژنتیک)، میتوان روند کاهش حافظه را در مدل حیوانی مبتلا به آلزایمر برعکس کرد. ژنیان نویسندهی ارشد این مقاله میگوید:
در این پژوهش، ما نهتنها عوامل اپیژنتیکی را که در کاهش حافظه نقش دارند، شناسایی کردیم؛ بلکه همچنین راههایی برای معکوس کردن موقت روند آن در یک مدل حیوانی مبتلا به آلزایمر پیدا کردیم.
این پژوهش روی موشهایی که دارای جهشهای ژنی مرتبط با آلزایمر خانوادگی (که بیش از یک عضو از خانواده مبتلا به آلزایمر میشوند) بودند و نیز بافت مغز مبتلایان به آلزایمر که از دنیا رفته بودند، انجام شد.
بیماری آلزایمر با ناهنجاریهای اپیژنتیک مرتبط است
مقالههای مرتبط:
بیماری آلزایمر هم حاصل عوامل ژنتیکی و هم عوامل محیطی نظیر افزایش سن است که با هم ترکیب میشوند و منجر به بروز تغییرات اپیژنتیک و تغییر در بیان ژنها میشوند، ولی دانش اندکی درمورد اینکه این وضعیت چگونه اتفاق میافتد، وجود دارد.
تغییرات اپیژنتیک در بیماری آلزایمر عمدتا در مراحل پایانی بیماری اتفاق میافتد؛ زمانیکه بیماران قادر به حفظ اطلاعاتی که جدیدا آنها را فرا گرفتهاند، نبوده و کاهش عملکرد شناختی شدیدی در آنها دیده میشود. یک دلیل کلیدی برای کاهش عملکرد شناختی، از دست دادن گیرندههای گلوتامات است که برای یادگیری و حافظهی کوتاهمدت حیاتی هستند. یان گفت:
ما متوجه شدیم که در بیماری آلزایمر بسیاری از زیرواحدهای گیرندهی گلوتامات در قشر پیشپیشانی مغز درجهت کاهشی تنظیم میشوند و سیگنالهای تحریکی قطع شده و موجب ضعف عملکرد حافظه میشود.
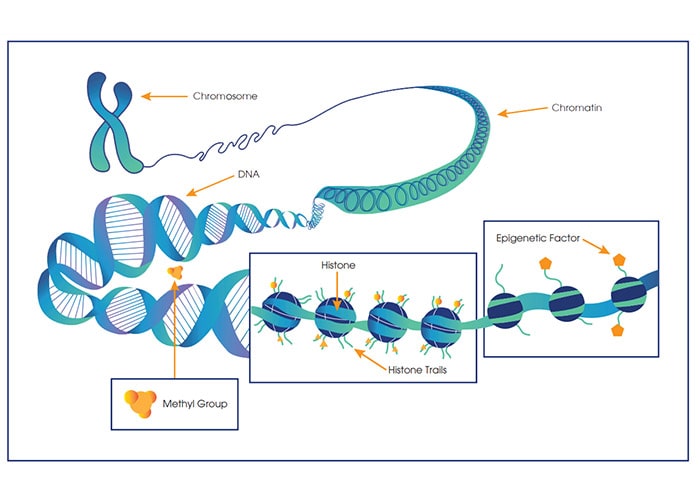
پژوهشگران دریافتند کاهش گیرندههای گلوتامات نتیجهای از یک فرایند اپیژنتیکی است که باعنوان تغییر مانع شوندگی هیستون شناخته میشود و در بیماری آلزایمر این فرایند افزایش مییابد. آنها این فرایند را هم در مدلهای حیوانی و هم در بافت مغز بیماران ازدنیارفتهی مبتلا به آلزایمر مشاهده کردند. یان توضیح داد که این وضعیت موجب تغییر ساختار کروماتین میشود؛ ساختاری که چگونگی دسترسی مواد ژنتیکی را به دستگاههای رونویسی سلول کنترل میکند. این تغییر غیرطبیعی هیستون در ارتباط با بیماری آلزایمر، چیزی است که منجر به سرکوب بیان ژن و کاهش گیرندههای گلوتامات و درنهایت منجر به از دست رفتن عملکرد سیناپسی و نقص در حافظه میشود.
اهداف دارویی ممکن
با درک این فرایند، میتوان به درمانهای جدیدی فکر کرد، زیرا تغییر هیستون توسط آنزیم کنترل یا کاتالیز میشود. یان گفت:
مطالعهی ما نهتنها همبستگی بین تغییرات اپیژنتیک و بیماری آلزایمر را نشان میدهد، بلکه ما متوجه شدیم که میتوانیم این اختلال شناختی را با هدف قرار دادن آنزیمهای اپیژنتیک بهمنظور بازیابی گیرندههای گلوتامات تصحیح کنیم.
حیوانات مبتلا به آلزایمر در این مطالعه، سه بار با ترکیبات طراحی شده برای مهار آنزیمی که فرایند تغییرات هیستون را کنترل میکند، تزریق شدند. یان گفت:
زمانیکه ما این مهارکنندهی آنزیمی را به حیوانات مبتلا به آلزایمر دادیم، شاهد بازیابی عملکرد شناختی در آنها بودیم؛ نتیجهای که ازطریق ارزیابی حافظهی شناختی، حافظهی فضایی و حافظهی کاری تأیید شد. ما با دیدن چنین بهبود شناختی چشمگیری شگفتزده شدیم و در همان زمان، شاهد بازیابی بیان گیرندههای گلوتامات و عملکرد در قشر پیشانی مغز بودیم.
این مزایا برای یک هفته باقی بود، مطالعات آینده روی توسعهی ترکیباتی که بتوانند بهطور موثرتری به مغز نفوذ کنند و تاثیر طولانیمدتی داشته باشند، تمرکز خواهد کرد.
مزیت روش اپیژنتیک
اختلالات مغزی نظیر آلزایمر اغلب بیماریهای پلیژنتیک هستند که در بروز آنها تعداد زیادی ژن نقش دارند و هرکدام از ژنها دارای اثر کمی هستند. در این رابطه استفاده از یک رویکرد اپیژنتیک یک مزیت محسوب میشود زیرا فرایندهای اپیژنتیک نهتنها یک ژن، بلکه تعداد زیادی از ژنها را کنترل میکنند. یان توضیح میدهد:
یک رویکرد اپیژنتیک میتواند شبکهای از ژنها را اصلاح کند و موجب بازگشت سلولها به وضعیت طبیعی و بازیابی عملکرد مغز شود. ما شواهدی را فراهم کردهایم که نشان میدهد تنظیم اپیژنتیک غیرطبیعی در بیان گیرندههای گلوتامات و عملکرد شناختی در بیماری آلزایمر نقش دارد. اگر تعداد زیادی از ژنهایی که در آلزایمر دچار تنظیم غیرطبیعی شدهاند، توسط دستکاری آنزیمهای اپیژنتیک خاص مورد هدف قرار گیرند، این امر امکانپذیر خواهد شد که عملکرد شناختی و رفتار آنها بازیابی شود.
.: Weblog Themes By Pichak :.
